В соответствии с действующим законодательством Украины неотъемлемой частью процесса регистрации, перерегистрации и обеспечения импорта лекарственных средств на территорию Украины является предоставление документа, подтверждающего условия производства лекарственных средств требованиям GMP:
- Заключение о признании GMP-сертификатов, выданных уполномоченными органами стран – членов ЕС, Великобритании или стран, имеющих соглашение о взаимном признании с ЕС или Украиной
или
- Сертификат соответствия условий производства лекарственных средств требованиям GMP.
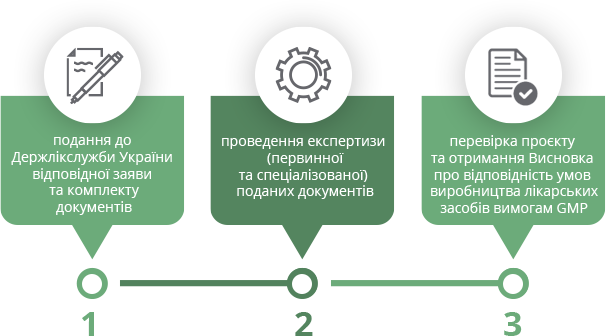
Выдача заключений или сертификатов осуществляется центральным органом исполнительной власти – Государственной службой Украины по лекарственным средствам и контролю за наркотиками (далее – Гослекслужба Украины) – в соответствии с «Порядком проведения подтверждения соответствия условий производства лекарственных средств требованиям надлежащей производственной практики», разработанным с учетом требований Директивы 2001/83/ЕС Европейского Парламента и утвержденным приказом Минздрава Украины от 27.12.2012 № 1130 (далее – Порядок).
Подтверждение соответствия условий производства лекарственных средств действующим в Украине требованиям GMP введено с целью доказательства того, что лекарственные средства постоянно производятся и контролируются в соответствии со стандартами качества, соответствующими их назначению, а также в соответствии с требованиями регистрационного досье, досье исследуемого лекарственного средства для клинических испытаний или спецификации на эту продукцию.